Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Os dispositivos de segurança denominados airbags contêm uma mistura de compostos químicos (azida de sódio e óxidos) e são rapidamente acionados em uma colisão brusca. Um impulso elétrico inicia uma série de reações químicas envolvendo NaN3, KNO3 e SiO2, que ocorrem na seqüência indicada pelas equações (1, 2 e 3), não balanceadas, mostradas abaixo. Considerando que o N2 é gerado nas duas reações, quantos litros de nitrogênio serão produzidos, aproximadamente, a 27°C e 1 atm de pressão a partir de 10 mols de NaN3? (Dado: R = 0,082 atm·L/mol·K.)
1. NaN3 → Na + N2
2. Na + KNO3 → K2O + Na2O + N2
3. K2O + Na2O + SiO2 → silicato alcalino
- A.
61,5.
- B.
123
- C.
246
- D.
394
- E.
984
Química - Reações, Soluções e Transformações Químicas - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Um haleto de alquila foi preparado segundo uma reação de substituição, representada pela seguinte equação química:
De acordo com as características desse tipo de reação, é correto afirmar que:
- A.
os halogenetos de isopropila são mais reativos do que os halogenetos de metila.
- B.
apenas o halogeneto de alquila participa da etapa cuja cinética está sendo medida.
- C.
a reação apresenta cinética de segunda ordem
- D.
apenas o nucleófilo, o íon cloreto, participa da etapa cuja cinética está sendo medida
- E.
essa reação ocorre em duas etapas.
Química - Reações, Soluções e Transformações Químicas - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
A determinação dos índices de demanda bioquímica de oxigênio (DBO) é realizada pela medida do oxigênio consumido em amostras de volumes conhecidos. Considerando que a biodegradação em uma fonte que contém 2,0 g de uréia por 100 litros de água ocorra de acordo com a equação química mostrada abaixo, indique o valor da DBO em questão.
CO(NH2)2 + 4 O2 → CO2 + 2 NO3- + 2 H+ + H2O
Dados - Massas molares em g/mol: uréia = 60, O2 = 32.
- A.
0,43 ppm.
- B.
4,26 ppm.
- C.
42,6 ppm.
- D.
0,22 ppm.
- E.
2,23 ppm.
Química - Reações, Soluções e Transformações Químicas - Instituto de Planejamento e Apoio ao Desenvolvimento Tecnológico e Científico (IPAD) - 2006
Dois compostos em análise reagem, segundo é ilustrado pelo diagrama de energia mostrado abaixo, que representa:
- A.
uma reação endotérmica lenta (alto ∆G , ∆Go positivo).
- B.
uma reação endotérmica rápida (baixo ∆G , ∆Go positivo, baixo).
- C.
uma reação endotérmica lenta (baixo ∆G , ∆Go = 0).
- D.
uma reação exotérmica rápida (baixo ∆G , ∆Go negativo, baixo).
- E.
uma reação exotérmica lenta (alto ∆G , ∆G negativo).
A molécula que pode sofrer reação de hidrogenação é
- A.
CH4
- B.
H3C − CH2 − CH3
- C.

- D.
H3C − CH2 − CH2 − CH3
- E.
H2C = CH2
Considere uma amostra de metanol (CH3OH). Quanto maior for a massa dessa amostra, maior será o valor
- A.
porcentagem, em massa, de cada elemento nela presente.
- B.
sua temperatura de ebulição, sob mesma pressão.
- C.
energia térmica liberada na sua combustão total.
- D.
sua pressão de vapor, na mesma temperatura.
- E.
sua densidade, na mesma temperatura.
Esta questão refere-se a duas soluções aquosas de um soluto A:
- A.
1,0 mol/L
- B.
0,60 mol/L
- C.
0,35 mol/L
- D.
0,30 mol/L
- E.
0,25 mol/L
O acetileno é um gás inflamável que pode ser obtido pela reação
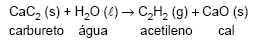
Quando se formam 52 g de acetileno, numa reação com 100% de rendimento, a massa de CaO gerada é
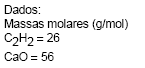
- A. 124 g
- B. 112 g
- C. 104 g
- D. 56 g
- E. 52 g
Considere as seguintes amostras:
São amostras com igual quantidade de átomos de hidrogênio:
- A.
I e II.
- B.
I e III.
- C.
I e IV.
- D.
II e IV.
- E.
III e IV.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2006
Texto para as questões 45 e 46
Uma das formas de se obter o gás hidrogênio é por meio da reação entre um metal e um ácido. A equação a seguir representa um exemplo de obtenção desse gás.
2 AL (s) + 6 HCL (aq) →2 ALCL3 (aq) + 3 H2 (g)
Considere que 400 mL de solução 0,3 mol/L de HCL foram preparados a partir de um ácido concentrado a 12 mol/L e que essa solução foi usada para reagir com alumínio, em uma reação com 100% de rendimento, sem excesso de nenhum dos reagentes, conforme a equação apresentada no texto. Acerca dessa situação, assinale a opção correta.
- A.
A quantidade de matéria de HCL presente em 400 mL de solução 0,3 mol/L é igual a 60 mmol.
- B.
O volume de ácido concentrado a 12 mol/L necessário para preparar 400 mL de solução 0,3 mol/L é igual a 100 mL.
- C.
O gás hidrogênio produzido nessa reação ocupa um volume inferior a 2 L nas CNTP.
- D.
No decorrer da reação, o pH diminuirá, pois ácido estará sendo consumido.


