Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2006
Texto para as questões 45 e 46
Uma das formas de se obter o gás hidrogênio é por meio da reação entre um metal e um ácido. A equação a seguir representa um exemplo de obtenção desse gás.
2 AL (s) + 6 HCL (aq) →2 ALCL3 (aq) + 3 H2 (g)
Considerando as informações do texto, assinale a opção correta.
- A.
Na reação, que ocorre com transferência de elétrons, o íon cloreto é o agente oxidante.
- B.
A equação expressa que o alumínio sólido reage com ácido clorídrico, produzindo o sal cloreto de alumínio, que fica dissolvido em água, e o gás hidrogênio.
- C.
Os coeficientes estequiométricos da equação estão de acordo com a Lei de Proust, também conhecida como lei da conservação das massas.
- D.
O hidrogênio é o gás de menor massa molar. Comparado com a mistura gasosa que compõe o ar, o gás hidrogênio se difunde com a menor velocidade entre todos os gases, conforme indica a seguinte equação, em que v é a velocidade e M é a massa molar.
Considere as afirmações abaixo.
I. A oxidação de álcoois secundários efetuada na presença de permanganato de potássio, em meio ácido, conduz à formação de aldeídos.
II. Os fenóis possuem um caráter ácido fraco, podendo sofrer ionização em água, liberando o ânion fenóxido.
III. A desidratação intramolecular de um álcool é feita sob aquecimento, na presença de um ácido forte e o produto resultante é um alceno.
É correto o que se afirma em
- A. I e II, apenas.
- B. I e III, apenas.
- C. II e III, apenas.
- D. III, apenas.
- E. I, II e III.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Paraná (UFPR) - 2006
A determinação da concentração de sulfato (SO42-) em águas pode ser efetuada baseando-se na reação: SO42- (aq) + Ba2+ (aq) BaSO4 (s). Considere as afirmativas a seguir:
- A.
Somente as afirmativas 1 e 3 são verdadeiras.
- B.
Somente as afirmativas 2 e 3 são verdadeiras.
- C.
Somente as afirmativas 2, 3 e 4 são verdadeiras.
- D.
Somente as afirmativas 1 e 4 são verdadeiras.
- E.
Somente as afirmativas 2 e 4 são verdadeiras.
A conversão de pentanal em 1-pentanol pode ser efetuada na presença de
- A. um agente oxidante como dicromato de potássio.
- B. um agente redutor como boroidreto de sódio.
- C. um agente oxidante como boroidreto de sódio.
- D. um agente redutor como dicromato de potássio.
- E. água, somente, sob aquecimento moderado.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Paraná (UFPR) - 2006
Um processo de titulação largamente empregado para determinar o íon cloreto em águas é baseado na reação química Cl-(aq) + Ag+ (aq) AgCl(s). Uma alíquota de 10,0 mL de uma amostra de água rica em íons Cl- foi diluída para um volume de 100,0 mL. Em seguida, uma alíquota de 10,0 mL dessa nova solução foi titulada com uma solução contendo Ag+ em concentração 0,010 mol L-1. Utilizando cromato de potássio como indicador do ponto final da titulação, foram gastos 15,0 mL da solução de Ag+. Assinale a alternativa que corresponde à concentração de íons cloreto na amostra de água original.
- A.
0,150 mol L-1
- B.
0,015 mol L-1
- C.
1,50 mol L-1
- D.
0,667 mol L-1
- E.
6,67 mol L-1
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Paraná (UFPR) - 2006
Considere três soluções: A – 100,0 mL de HCl 0,01 mol L-1, B – 50,0 mL de HCl 0,01 mol L-1 + 50,0 mL de NaOH 0,01 mol L-1 e C – idem à solução B, porém contendo um leve excesso de solução de NaOH 0,01 mol L-1. Assinale a alternativa que corresponde, respectivamente, aos valores de pH das soluções A, B e C.
- A.
6,0, 7,0 e 8,0
- B.
7,5, 4,0 e 2,0
- C.
2,0, 6,0 e 7,0
- D.
8,0, 7,0 e 2,0
- E.
2,0, 7,0 e 8,0
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Paraná (UFPR) - 2006
Um átomo pode ganhar ou perder elétrons. Quando esse fenômeno ocorre, o átomo deixa de ser eletricamente neutro e passa a ser chamado genericamente de íon. Os íons podem ser cátions ou ânions. Nesse contexto, considere as proposições abaixo.
- A.
Somente as afirmativas 1, 2 e 4 são verdadeiras.
- B.
Somente as afirmativas 1 e 3 são verdadeiras.
- C.
Somente as afirmativas 2 e 4 são verdadeiras.
- D.
Somente as afirmativas 2, 3, e 4 são verdadeiras.
- E.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Química - Reações, Soluções e Transformações Químicas - Universidade Federal do Paraná (UFPR) - 2006
320 mL de antiácido contêm 11,9 g de Al(OH)3 e 12,8 g de Mg(OH)2. Considere as afirmativas abaixo: (Massas atômicas (g mol-1): Al = 27; O = 16; H = 1; Mg = 24,3; Cl = 35,5.)
- A.
Somente as afirmativas 1, 2 e 4 são verdadeiras.
- B.
Somente as afirmativas 1 e 3 são verdadeiras.
- C.
Somente as afirmativas 2 e 4 são verdadeiras.
- D.
Somente as afirmativas 2, 3, e 4 são verdadeiras.
- E.
Somente as afirmativas 3 e 4 são verdadeiras.
Uma certa quantidade de um gás ideal percorre o ciclo 1-2-3-1, cuja dependência do volume, em relação à temperatura, está representada pelo gráfico abaixo. A dependência da pressão em relação ao volume para este ciclo é representada por: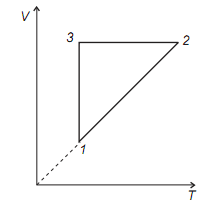
- A.

- B.

- C.

- D.

- E.

O cobre pode ser obtido a partir da reação da calcosita (Cu2
com a cuprita (Cu2 O), conforme a reação abaixo.
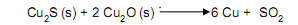
Ao reagir 260g de cuprita contendo 45% de impureza
com calcosita suficiente, foram obtidos 152,4g de cobre.
O rendimento da reação foi de:
(Dados - Massa molares: Cu = 63,5g/mol; S = 32 g/mol;
O = 16 g/mol)
- A.
100%
- B.
95%
- C.
90%
- D.
80%
- E.
75%


