Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
 As ligações químicas predominantes no Fe(s), C(s), Fe2O3(s) e CO(g) são, respectivamente, metálica, covalente, iônica e covalente.
As ligações químicas predominantes no Fe(s), C(s), Fe2O3(s) e CO(g) são, respectivamente, metálica, covalente, iônica e covalente.
- C. Certo
- E. Errado
Apesar da relação direta com os metais, o fenômeno da corrosão ocorre, também, com outros materiais como concreto e polímeros orgânicos. Sobre corrosão, considere as afirmativas a seguir.
I - A água do mar é considerada um meio corrosivo, e o solo é considerado um meio inerte, não corrosivo.
II - A corrosão do ferro é um processo espontâneo e representa a tendência de formação de um produto mais estável.
III - A proteção catódica é uma escolha adequada para revestir superfícies metálicas passíveis de corrosão.
Está correto APENAS o que se afirma em
- A.
I
- B.
II
- C.
III
- D.
I e II
- E.
II e III
A reação de ozônio com alcenos pode ser empregada para a identificação estrutural desta classe de hidrocarboneto.
PORQUE A reação de ozonólise de alcenos, seguida de tratamento com Zn e H2O ou ácido acético, leva à quebra da ligação dupla e à formação de compostos carbonilados. Analisando as afirmações acima, conclui-se que- A. as duas afirmações são verdadeiras e a segunda justifica a primeira.
- B. as duas afirmações são verdadeiras e a segunda não justifica a primeira.
- C. a primeira afirmação é verdadeira e a segunda é falsa.
- D. a primeira afirmação é falsa e a segunda é verdadeira.
- E. as duas afirmações são falsas.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
 O volume de CO2(g) liberado por grama de Fe(s) produzido é maior na reação II que na reação I.
O volume de CO2(g) liberado por grama de Fe(s) produzido é maior na reação II que na reação I.
- C. Certo
- E. Errado
Um álcool de fórmula molecular C7H14O foi oxidado por K2Cr2O7 em meio ácido, fornecendo um produto com fórmula molecular C7H12O. Este mesmo álcool é inerte frente à água de bromo (Br2/H2O). Qual dos alcoóis a seguir apresenta essas características químicas?
- A. Hept-3-en-2-o
- B. Hept-4-en-2-ol
- C. Hept-3-en-1-ol
- D. 2-Metil-cicloexano
- E. 1-Metil-cicloexanol
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
 O calor liberado na combustão completa de 24,0 g de carbono grafite, a 1 bar e 25 ºC, é superior a 600 kJ.
O calor liberado na combustão completa de 24,0 g de carbono grafite, a 1 bar e 25 ºC, é superior a 600 kJ.
- C. Certo
- E. Errado
A enorme quantidade de sabões e detergentes lançada nos rios e lagos diariamente acaba atingindo níveis de concentração nocivos ao meio ambiente. Apesar dos detergentes serem mais eficientes na remoção da gordura, os sabões são preferíveis, por serem bastante biodegradáveis. O uso contínuo e em escala cada vez maior de sabões pode acarretar
- A.
a formação de manchas de óleo na superfície das águas.
- B.
a alteração do pH da água nos reservatórios naturais.
- C.
a proliferação de algas.
- D.
o aumento da concentração de materiais fosfatados nos reservatórios.
- E.
a morte de micro-organismos anaeróbicos.
Considere o sistema:
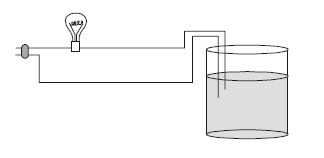
No sistema representado acima, uma lâmpada de 40 watts deve acender quando o líquido existente no béquer for
- A.
água + sacarose (C12H22O11).
- B.
água destilada.
- C.
NaOH (aq).
- D.
gasolina.
- E.
etanol.
O ácido fosfórico (H3PO4) é um ácido mais forte que o ácido nítrico (HNO3).
PORQUE O ácido fosfórico possui mais hidrogênios ionizáveis que o ácido nítrico. Analisando as afirmações acima, conclui-se que- A. as duas afirmações são verdadeiras e a segunda justifica a primeira.
- B. as duas afirmações são verdadeiras e a segunda não justifica a primeira.
- C. a primeira afirmação é verdadeira e a segunda é falsa.
- D. a primeira afirmação é falsa e a segunda é verdadeira.
- E. as duas afirmações são falsas.
Ao se colocar gelo-seco em um béquer contendo uma solução rosa de NaOH 0,1 mol/l com fenolftaleína, verificase que a mesma descora. Isso acontece porque
Dado: Faixa de viragem da fenolftaleína: de pH 8,2 a 10,0
- A.
os íons OH- aumentaram na solução.
- B.
o pH da solução aumentou.
- C.
o pH da solução diminuiu.
- D.
o gelo-seco é constituído por moléculas com acentuada polaridade.
- E.
o gelo-seco sofreu sublimação.


