Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Sabendo-se que o óxido de alumínio (Al2O3) é obtido a partir da reação do alumínio com o gás oxigênio (O2), a quantidade de alumínio, em mol, necessária para se obter 51,0 g do óxido é

- A.
0,25.
- B.
0,5.
- C.
1,0.
- D.
2,0.
- E.
2,5.
A água do mar possui grande quantidade de sólidos e elementos dissolvidos, podendo-se admitir, a princípio, que todos os elementos químicos existentes em terra encontram- se dissolvidos no mar. Seis íons inorgânicos compreendem 99,28% da massa total dos materiais dissolvidos. São eles, em ordem decrescente de abundância:
- A.
Na+, Cl−, SO4 2−, H3BO3 e Mg2+
- B.
Na+, Br−, H3BO3, K+ e HCO3 −
- C.
Na+, Cl−, Ca2+, Sr2+, H3BO3 e K+
- D.
Cl−, Na+, K+, Br−, I− e HCO3 −
- E.
Cl−, Na+, SO4 2−, Mg2+, Ca2+ e K+
Foram muitos os casos de asfixia em pessoas que misturaram água sanitária, amoníaco e sabão em pó para a limpeza de cozinhas e banheiros. Essa asfixia decorre da
- A.
dissolução do sabão em pó na água.
- B.
evaporação dos ingredientes dos produtos utilizados.
- C.
produção de gases tóxicos por transformação química.
- D.
reação das substâncias presentes nos produtos com o nitrogênio do ar.
- E.
formação de uma solução aquosa salina tóxica.
A transformação química que ocorre quando se adiciona a um tubo de ensaio solução aquosa de sulfato de cobre (II) e um chumaço de esponja de aço (ferro) é evidenciada pela
- A.
efervescência e formação de um líquido vermelho.
- B.
formação de um sólido gelatinoso e liberação de energia térmica.
- C.
diminuição de temperatura e desaparecimento de um sólido.
- D.
formação de um sólido avermelhado e descoramento da solução.
- E.
luminescência e formação de um líquido colorido.
Os dados a seguir referem-se à entalpia de combustão de alguns materiais.
Gasolina (média) −5 400 kJ/mol
Etanol −1 368 kJ/mol GLP (média) −2 600 kJ/mol
Metano −890 kJ/mol Carvão −393 kJ/mol
Dos combustíveis apresentados, aquele que pode ser obtido de fonte renovável e com melhor eficiência energética por mol é
- A.
o carvão.
- B.
o etanol.
- C.
o gás de cozinha.
- D.
a gasolina.
- E.
o metano.
Atenção: Considere as seguintes reações de combustão do metano, para responder às questões de números 35 e 36.
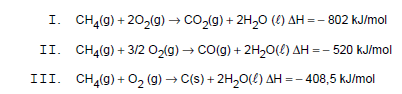
Observando as reações de combustão do metano, podese concluir que, quando comparados aos reagentes, os produtos da reação
- A.
I possuem mais energia armazenada que os da reação II.
- B.
I possuem menos energia armazenada que os da reação III.
- C.
II possuem menos energia armazenada que os da reação I.
- D.
II possuem mais energia armazenada que os da reação III.
- E.
III possuem menos energia armazenada que os da reação I.
Atenção: Considere as seguintes reações de combustão do metano, para responder às questões de números 35 e 36.
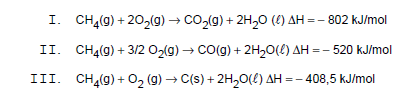
É produzido um gás estufa e um composto venenoso para os seres humanos, respectivamente, nas reações representadas em
- A.
I e II.
- B.
I e III.
- C.
II e III.
- D.
II e I.
- E.
III e II.
No controle da hiperacidez estomacal pode-se utilizar uma solução de comprimido antiácido contendo carbonato e bicarbonato. Nessa solução encontram-se os equilíbrios representados pelas seguintes equações:
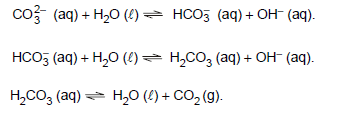
Quando ingerida, essa solução reage com o ácido estomacal e, como consequência, ocorre
- A.
aumento da concentração de íons CO32- (aq).
- B.
desidratação estomacal.
- C.
aumento da concentração de íons H+ (aq).
- D.
liberação de gás.
- E.
diminuição do pH dentro do estômago.
A obtenção do sal da água do mar se dá pela retirada do sal sólido à medida que evapora a água do mar contida em grandes tanques. Nesse processo é obtido sal com teor de mais de 95% em NaCl. Esse alto teor de NaCl é possível porque
- A.
a água do mar tem esse teor de NaCl.
- B.
o NaCl é obtido por cristalização fracionada.
- C.
a temperatura de ebulição da água é maior que a do NaCl.
- D.
a densidade do NaCl é maior que a da água.
- E.
a temperatura de fusão da água é maior que a do NaCl.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
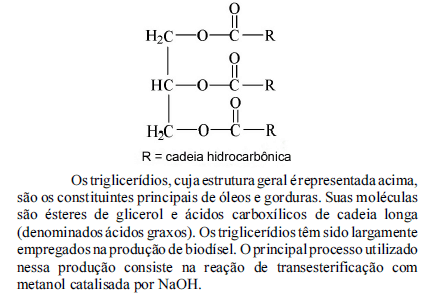
A respeito dos compostos e da reação de transesterificação mencionada, julgue os itens de 111 a 115.
A reação de transesterificação do triglicerídio com metanol leva à obtenção de um produto com a fórmula geral abaixo.
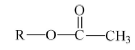
- C. Certo
- E. Errado


