Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A reação de obtenção de metano gasoso e vapor dágua a partir de monóxido de carbono gasoso e hidrogênio gasoso, chamada de reação de metanação, é uma reação reversível e exotérmica. Com relação a essa reação em equilíbrio, afirma-se que
- A.
um aumento na concentração de água desloca o equilíbrio químico no sentido da formação do metano.
- B.
um aumento na concentração de monóxido de carbono desloca o equilíbrio químico no sentido da formação do metano.
- C.
a produção de metano aumenta com o aumento da temperatura.
- D.
a adição de um catalisador aumenta a formação do metano.
- E.
o equilíbrio químico é atingido quando a concentração de metano é igual à concentração de hidrogênio.
Uma solução estoque, com concentração de 1,00.103 miligramas de ferro por litro, foi preparada a partir do seguinte procedimento: adição lenta de 20 mL de ácido sulfúrico em 50 mL de água deionizada, seguida de dissolução de uma determinada massa de sulfato ferroso amoniacal hexa- hidratado, Fe(NH4)2(SO4)2 .6H2O; adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de Fe(NH4)2(SO4)2 .6H2O, em gramas, utilizada nesse procedimento, foi de
- A.
0,255
- B.
1,255
- C.
1,755
- D.
2,555
- E.
7,055

- A.
10
- B.
5
- C.
3
- D.
2
- E.
1
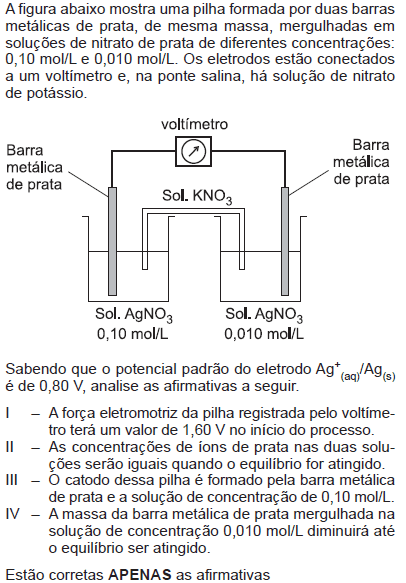
- A.
I e II.
- B.
I e IV.
- C.
II e III.
- D.
I, III e IV.
- E.
II, III e IV.
Em um recipiente de volume V, há 15 gramas de um gás ideal que se encontra a uma pressão P e a uma temperatura T. Em outro recipiente de volume igual ao do primeiro, com 1 grama de hidrogênio (também considerado ideal), verificou-se que os valores de pressão e temperatura eram os mesmos do primeiro recipiente. A partir desses dados, a massa molecular do gás contido no primeiro recipiente é igual a
- A.
5 u
- B.
15 u
- C.
25 u
- D.
30 u
- E.
45 u
Quando se dissolvem 32 g de um determinado soluto não volátil X em 400 g de água, a solução não eletrolítica formada ferve a 101,04 ºC, a 1 atm. A massa molar de X, em g/mol, é
Dados : Constante do ponto de ebulição = 0,52 ºC.kg.mol−1
- A.
10
- B.
20
- C.
30
- D.
40
- E.
50
Qual o produto formado pela reação do metilpropeno com ácido clorídrico?
- A.
Isobutano
- B.
1-buteno
- C.
2-cloro-metilpropano
- D.
1-cloro-metilpropano
- E.
1-cloro-metilpropeno
Uma solução 0,20 M de hidróxido de sódio precisa ser preparada para ser usada em uma reação de neutralização. A forma correta de preparação dessa solução seria dissolver X gramas de hidróxido de sódio em Y litros de solução. São valores possíveis para X e Y são, respectivamente,
- A.
2,0 e 0,50
- B.
4,0 e 0,25
- C.
4,0 e 0,50
- D.
8,0 e 0,75
- E.
8,0 e 1,50

- A.
eletrodo de referência foi utilizado para determinar o teor de cloreto na amostra.
- B.
ajuste do pH da solução para 5,5 é importante para minimizar a formação de HF e a interferência de OH−.
- C.
teor de fluoreto de sódio na amostra foi de 1,00%.
- D.
nivelador de força iônica serve para impedir a ionização do flúor.
- E.
membrana do eletrodo íon-seletivo de fluoreto é um cristal prensado de fluoreto de sódio.

- A.

- B.

- C.

- D.

- E.



