Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Praticamente dois terços de nosso planeta são cobertos por água. Essa substância é também a mais abundante no organismo humano. Sendo a água tão comum, tem-se a tendência de considerar triviais suas propriedades químicas e físicas. Entretanto, ela possui muitas propriedades não usuais e essenciais à vida na Terra. Uma das propriedades mais importantes da água é a sua capacidade de dissolver uma grande variedade de substâncias. Por essa razão, a água é encontrada na natureza com um vasto número de substâncias nela dissolvidas. Como exemplo dessas substâncias, podem-se citar materiais radioativos, matérias orgânicas, coloides e metais pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a seguir, a respeito de aspectos diversos de química.
Uma forma eficaz de identificar um coloide é analisar o diâmetro da molécula do dispersante.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2011
Praticamente dois terços de nosso planeta são cobertos por água. Essa substância é também a mais abundante no organismo humano. Sendo a água tão comum, tem-se a tendência de considerar triviais suas propriedades químicas e físicas. Entretanto, ela possui muitas propriedades não usuais e essenciais à vida na Terra. Uma das propriedades mais importantes da água é a sua capacidade de dissolver uma grande variedade de substâncias. Por essa razão, a água é encontrada na natureza com um vasto número de substâncias nela dissolvidas. Como exemplo dessas substâncias, podem-se citar materiais radioativos, matérias orgânicas, coloides e metais pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a seguir, a respeito de aspectos diversos de química.

- C. Certo
- E. Errado
Uma amostra de 500 mg de calcário (carbonato de cálcio) impuro foi introduzida em um tubo de ensaio com saída lateral. Para esse tubo foi transferida, em excesso, solução de ácido clorídrico, que reagiu completamente com o carbonato de cálcio presente na amostra. O gás liberado foi recolhido em um cilindro de vidro de 500,0 cm3 de volume interno e altura de 500,0 mm. O cilindro estava completamente cheio de líquido inerte e imiscível com o gás e, conforme o gás entrava no cilindro, o líquido era expulso, sendo possível medir o volume de gás liberado pela reação. Ao final do experimento, o líquido ocupava 400,0 mm da altura do cilindro. A percentagem de carbonato de cálcio, na amostra de calcário, considerando-se que, nas condições do experimento, o volume molar dos gases é de 25,0 L/mol e as impurezas presentes são inertes, é
- A.
25%
- B.
40%
- C.
60%
- D.
80%
- E.
95%

- A.
I e II.
- B.
I e IV.
- C.
II e III.
- D.
I, III e IV.
- E.
II, III e IV.
Uma amostra de 20 mL de sulfato de ferro (II) e de amônio 0,1 M foi analisada por titulação potenciométrica com uma solução de sulfato de cério (IV) 0,1095 M, usando-se eletrodos de platina e de calomelano saturado. Observando essa análise potenciométrica, analise as afirmativas abaixo.
I - O eletrodo de calomelano é um eletrodo de referência e é composto de mercúrio e cloreto de mercúrio (I), cobertos com uma solução de cloreto de potássio saturada.
II - Nessa análise potenciométrica, o cério se oxida a Ce3+, e o ferro se reduz a Fe3+.
III - Trata-se de uma potenciometria direta, e o eletrodo indicador é a platina.
Está correto o que se afirma em
- A.
I, apenas.
- B.
II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Considere que, no início do experimento, em vez de 56 g de but-1-eno, foram utilizados 56 g de monóxido de carbono. Os gases nitrogênio e monóxido de carbono não reagem entre si e apresentam comportamento ideal. Na câmara P, antes da Válv. 2 ser aberta, a temperatura do sistema era, também, de 300 K, e a pressão medida do sistema foi de P2. A relação entre as pressões, utilizando o but-1-eno, P1, e o monóxido de carbono, P2, é
- A.
P1 = P2
- B.
P1 = 2P2
- C.
2P1 = P2
- D.
2P1 = 3P2
- E.
3P1 = 2P2
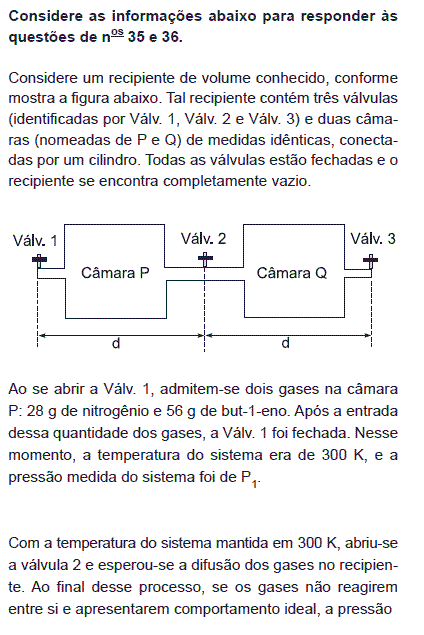
- A.
final do sistema será igual a P1.
- B.
final do sistema será igual ao dobro de P1.
- C.
parcial dos dois gases permanecerá constante.
- D.
parcial do gás nitrogênio será quatro vezes menor que P1.
- E.
parcial do but-1-eno será o dobro da do nitrogênio.

- A.
4,7
- B.
7,0
- C.
8,8
- D.
9,3
- E.
13,0
O teor de peróxido de hidrogênio em água oxigenada pode ser determinado por titulação com solução de permanganato de potássio, tanto em meio ácido como em meio alcalino. Se a titulação de uma determinada amostra consumiu 12,6 mL de solução de KMnO4 0,1N, quando conduzida em meio ácido, qual seria o consumo esperado, em mL, caso a titulação fosse conduzida em meio alcalino?
- A.
25,2
- B.
21,0
- C.
12,6
- D.
6,3
- E.
4,2

- A.
é uma oxirredução, e o elemento oxidado é o Na.
- B.
é uma oxirredução, e o elemento oxidado é o O.
- C.
é uma oxirredução, e o elemento oxidado é o H.
- D.
é uma oxirredução, e o elemento oxidado é o Cl.
- E.
não é uma oxirredução, portanto, nenhum elemento é oxidado.


