Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP)
Lista completa de Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Radioatividade - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Sobre tópicos de radioquímica são feitas as seguintes afirmações:
I. As emissões gama, alfa e raios X têm como característica comum o efeito ionizante. II. A radiação gama tem maior comprimento de onda que o da luz visível. III. Dois tipos usuais de equipamentos empregados em medidas radiométricas para radiação gama são os cintiladores e as câmaras de ionização. De acordo com a atribuição verdadeira (V) e falsa (F), as afirmativas I, II e III são classificadas, correta e respectivamente, como- A.
F; F; V.
- B.
F; V; V.
- C.
F; V; F.
- D.
V; V; F.
- E.
V; F; V.
Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Atualmente, o etanol é amplamente usado como combustível veicular no Brasil devido a aspectos ambientais. Contudo, o programa Pró-álcool foi criado na década de 70 em decorrência da crise do petróleo. A preocupação de alguns grupos de pesquisa, naquela época, era também de substituir alguns derivados de petróleo usados na fabricação de polímeros, caso essa matéria-prima viesse a faltar. Nesse sentido, o etanol pode ser utilizado como matéria-prima para produção de __________ por reação de __________ utilizando- se catalisadores adequados. O gerado nessa reação é empregado como monômero na fabricação do __________ que tem diversas aplicações.
As lacunas do texto são preenchidas, correta e respectivamente, por:- A.
eteno desidratação catalítica eteno PE
- B.
eteno desidratação catalítica eteno PET
- C.
eteno substituição nucleofílica eteno PE
- D.
cloreto de vinila substituição eletrofílica cloreto de vinila PET
- E.
cloreto de vinila substituição nucleofílica cloreto de vinila PVC
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O benzeno tem estabilidade, pois as duplas ligações do anel benzênico encontram-se deslocalizadas. No entanto, a presença de substituintes no anel benzênico pode afetar a reatividade e a susceptibilidade ao ataque eletrofílico. Cálculos de orbitais moleculares permitem concluir que há maior concentração de elétrons no anel do fenol do que no anel do benzeno, particularmente nas posições orto e para, favorecendo a substituição eletrofílica nessas posições. Outros substituintes que têm o mesmo efeito são:
- A.
NH2; Cl ; Br.
- B.
NH2; COOH ; Br.
- C.
NH2; COOH ; CN.
- D.
COOH; Br; NO2.
- E.
COOH; CN; NO2.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Sobre as propriedades químicas dos compostos orgânicos oxigenados, afirma-se que _____________ são oxidados por agentes oxidantes fortes resultando em _____________.
As lacunas do texto são preenchidas, correta e respectivamente, por:- A.
aldeídos éteres
- B.
álcoois primários esteres
- C.
álcoois secundários cetonas
- D.
álcoois terciários aldeído
- E.
ésteres aldeídos.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Nas reações orgânicas pode ocorrer a formação de grupos intermediários instáveis nos quais o átomo de carbono não apresenta quatro ligações. Esses grupos se originam da ruptura de ligações entre átomos, que pode ocorrer de forma homogênea ou heterogênea. Denomina-se ruptura ______________ quando a ligação entre átomos com ______________ eletronegatividade se rompe e origina ______________ .
As lacunas do texto são preenchidas, correta e respectivamente, por:- A.
homolítica iguais radicais livres
- B.
homolítica iguais carbocátions ou carbânion
- C.
homolítica diferentes radicais livres
- D.
heterolítica iguais carbocátion ou carbânion
- E.
heterolítica diferentes radicais livres
Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
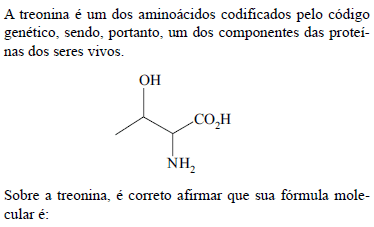
- A.
C3H7O3N; é uma molécula aquiral e tem dois isômeros ópticos.
- B.
C3H7O3N; é uma molécula quiral e tem dois isômeros ópticos.
- C.
C4H9O3N; é uma molécula quiral e tem dois isômeros ópticos.
- D.
C4H9O3N; é uma molécula aquiral e tem quatro isômeros ópticos.
- E.
C4H9O3N; é uma molécula quiral e tem quatro isômeros ópticos.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
No estudo da alotropia, um exemplo clássico é o caso dos alótropos naturais do carbono, pois, sem dúvida alguma, apresentam as diferenças de propriedades físicas mais pronunciadas entre os alótropos que ocorrem na natureza. Uma forma de explicar as diferentes propriedades desses alótropos está baseada no conjunto de orbitais híbridos que formam as ligações nos átomos de carbono.
O _____________ apresenta hibridização _____________ que resulta em uma estrutura cúbica modificada, em que cada átomo de carbono está ligado a outros átomos de carbono com ângulos de ligações idênticos e de aproximadamente 109,5º.
O _____________ apresenta hibridização _____________ , que resulta em estrutura planar, em que cada átomo de carbono está ligado a outros átomos de carbono com ângulo de ligação de 120º. Nessa estrutura, também se forma uma ligação π deslocalizada ao longo de todo plano de ligação.
As lacunas do texto são, preenchidas, correta e respectivamente, por:
- A.
diamante sp2 grafite sp3
- B.
diamante sp3 grafite sp2
- C.
diamante sp grafite sp3
- D.
grafite sp diamante sp2
- E.
grafite sp2 diamante sp3
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
não é espontânea em qualquer faixa de temperatura.
- B.
é espontânea independente da faixa de temperatura.
- C.
é espontânea se |TΔS|> ΔH.
- D.
é espontânea se |TΔS|< ΔH.
- E.
é espontânea se |TS|= ΔH.
Química - Termoquímica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
553.
- B.
- 703.
- C.
1361.
- D.
+ 553.
- E.
+ 1375.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Foram preparadas separadamente, usando água purificada por destilação e por troca iônica (pH =7), soluções 1,0 mol . L 1 de
Acetato de sódio;
Oxalato de potássio;
Carbonato de sódio;
Nitrato de amônio;
Cloreto de alumínio.
Medindo-se seus valores de pH a 25 ºC, verifica-se corretamente que apresentam valores de pH < 7 as soluções de
- A.
acetato de sódio e carbonato de sódio.
- B.
acetato de sódio e oxalato de potássio.
- C.
cloreto de alumínio e carbonato de sódio.
- D.
nitrato de amônio oxalato de potássio.
- E.
nitrato de amônio e cloreto de alumínio.


