Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP)
Lista completa de Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

As propriedades físicas que justificam a expressão flutua na água, conforme consta das informações sobre a aparência do acetato de amila, são
- A.
densidade e viscosidade.
- B.
solubilidade em água e densidade.
- C.
solubilidade em água e viscosidade.
- D.
viscosidade e temperatura de fusão.
- E.
temperatura de fusão e solubilidade em água.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

Para identificação do acetato de amila para fins de movimentação, armazenamento, manuseio e transporte terrestre, deve ser colada no espaço da ficha, reservado ao rótulo de risco, a seguinte figura:
- A.

- B.

- C.

- D.

- E.

Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

Para incluir, entre os nomes fornecidos na ficha para o acetato de amila, mais um sinônimo para essa substância, é correto acrescentar
- A.
metoxipentano.
- B.
etanoato de pentila.
- C.
etanoato de N-amila.
- D.
pentanol-1-acetato
- E.
acetato de 1-pentanila.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
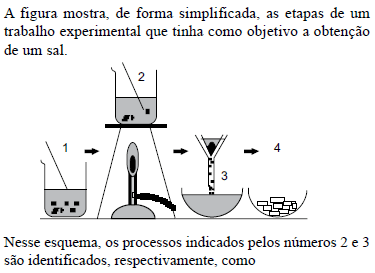
- A.
dissolução e filtração.
- B.
condensação e filtração.
- C.
evaporação e cristalização.
- D.
evaporação e solidificação.
- E.
condensação e sedimentação.
Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
A história do desenvolvimento do modelo atômico é um exemplo de como os modelos científicos são atualizados à medida que avança o conhecimento. Leia:
400 a.C. Demócrito: o átomo é a menor partícula que constitui a matéria.
1803 J. Dalton: a matéria é formada por átomos que são esferas perfeitas, como bolas de bilhar. 1904 J.J Thomson: o átomo é maciço, formado por uma esfera positiva na qual se distribuem, segundo critérios definidos, corpúsculos negativos.
1911 E. Rutherford: o átomo é constituído de um núcleo carregado positivamente rodeado por uma nuvem de elétrons.
1913 N. Bohr: o átomo é constituído de um núcleo em torno do qual circula uma nuvem de elétrons dispersos no espaço em regiões de energia discreta.
Dentre os modelos citados, aquele que permite explicar as cores que certos sais emitem quando aquecidos em um bico de gás é o modelo proposto por
- A.
Niels Bohr.
- B.
Demócrito.
- C.
John Dalton.
- D.
J.J. Thomson.
- E.
Ernest Rutherford.
Química - Química Orgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O composto representado pela fórmula condensada
C2H5 (COO) C2H5 é um(a)- A.
cetona.
- B.
éter.
- C.
éster.
- D.
aldeído.
- E.
ácido carboxílico.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O indicador metalocrômico conhecido como negro de eriocromo T é empregado na análise de cálcio por
- A.
volumetria com EDTA.
- B.
volumetria com permanganato.
- C.
volumetria com iodeto.
- D.
gravimetria com sulfato.
- E.
gravimetria com oxalato.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
oxigênio se reduz e o elemento hidrogênio se oxida.
- B.
hidrogênio se oxida e também se reduz.
- C.
oxigênio se oxida e o elemento hidrogênio se reduz.
- D.
oxigênio se oxida e também se reduz.
- E.
hidrogênio se oxida e o elemento oxigênio também.
Química - Termoquímica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
água destilada e de vinagre.
- B.
água de cal e de água destilada.
- C.
suco de limão e de vinagre.
- D.
suco de limão e de água destilada.
- E.
água de cal e de vinagre.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
O aumento de pressão do sistema acarretará maior rendimento em produto do equilíbrio representado por:
- A.

- B.

- C.

- D.

- E.



