Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015

A tabela acima apresenta reagentes utilizados para o preparo de algumas soluções. Com base nessas informações, julgue os itens a seguir.
Em 500 mL de uma solução de NaOH 0,2 mol/L, a massa de NaOH contida é maior que 5,0 g.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
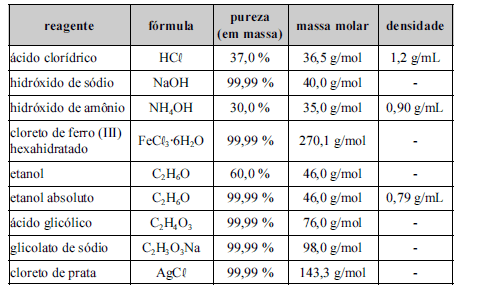
A tabela acima apresenta reagentes utilizados para o preparo de algumas soluções. Com base nessas informações, julgue os itens a seguir.
Para se preparar 1,0 L de uma solução aquosa 0,1 mol/L de Fe3+ são necessários 10,8 g do reagente FeCl 3·6H2O.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015

A tabela acima apresenta reagentes utilizados para o preparo de algumas soluções. Com base nessas informações, julgue os itens a seguir.
O pH de uma solução obtida pela mistura de 50 mL de NaOH 0,1 mol/L e 50 mL de HCR 0,25 mol/L é inferior a 2.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015

A tabela acima apresenta reagentes utilizados para o preparo de algumas soluções. Com base nessas informações, julgue os itens a seguir.
Considerando-se que a constante do produto de solubilidade do cloreto de prata em água seja 1,0×10-10 mol/L, em uma solução saturada desse sal a concentração de íons prata será superior a 5,0 mg/L.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015

Na tabela acima, listam-se alguns reagentes existentes em laboratórios de aulas práticas de química. Acerca dos materiais listados na tabela, julgue os itens a seguir.
Da reação química entre os compostos dos frascos 1 e 2 origina-se o sulfato de cálcio.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
Julgue os itens que se seguem, com relação à estequiometria. Para o julgamento, considere que o volume molar de um gás nas condições normais de temperatura e pressão corresponda a 22,4 mol/L. A fórmula molecular H12C4O3 apresenta como fórmula mínima e fórmula percentual H4C2O1 e H9,09%C54,54%O36,36%, respectivamente.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
Julgue os itens que se seguem, com relação à estequiometria. Para o julgamento, considere que o volume molar de um gás nas condições normais de temperatura e pressão corresponda a 22,4 mol/L. Se 8 g de H2 reagem com 64 g de gás O2, produzindo 72 g de H2O, então a fórmula percentual é H11,11%O88,89%.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
Julgue os itens que se seguem, com relação à estequiometria. Para o julgamento, considere que o volume molar de um gás nas condições normais de temperatura e pressão corresponda a 22,4 mol/L. Em uma reação química, a massa total de reagentes obrigatoriamente deve ser diferente da massa total dos produtos.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
Durante uma aula prática, um aluno deixou cair 25 mL de solução de H2SO4, na concentração de 2 mol/L, sobre a bancada do laboratório de química.
Acerca dessa situação hipotética, julgue os itens a seguir.
Na situação descrita acima, recomenda-se a adição de sais, tais como carbonato de sódio e bicarbonato de sódio, ambos em estado sólido, à solução ácida derramada.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2015
Durante uma aula prática, um aluno deixou cair 25 mL de solução de H2SO4, na concentração de 2 mol/L, sobre a bancada do laboratório de química.
Acerca dessa situação hipotética, julgue os itens a seguir.
A fim de se remediar o ocorrido no laboratório, deve-se adicionar sulfato de sódio em estado sólido à solução ácida derramada.- C. Certo
- E. Errado


