Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Em uma certa reação endotérmica, em pressão constante, 50 kJ de energia entraram no sistema na forma de calor; 20 kJ de energia deixaram o sistema na forma de trabalho de expansão para deixar espaço para os produtos. Quais são os valores de ΔH e ΔU desse processo?
- A.

- B.

- C.

- D.

- E.

Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
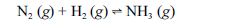
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Sabendo que a solubilidade do NH3 ,em 1 L de água, a 0 °C e 1 atm de pressão, é de 1.300 L, é correto concluir que as substâncias NH3 e H2O são fortemente polarizadas.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
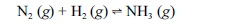
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Borbulhando-se NH3 em água, a solução resultante forma um ácido de Arrhenius.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
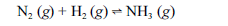
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Na síntese de NH3, reagentes e produto são moleculares. Nessas substâncias, as ligações entre os átomos são covalentes.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Como ponto de partida para o desenvolvimento de conteúdos e para a compreensão da química no ensino médio, destaca-se o conceito de substância química, base do pensamento químico moderno. Acerca desse conceito, julgue os itens seguintes.
I Toda substância química, independentemente de sua origem ou de sua forma de obtenção, apresenta um conjunto de propriedades específicas e bem definidas.
II A obtenção de uma substância como, por exemplo, o ferro, a partir de um minério como a hematita (Fe 2 O 3 ), ocorre por meio de uma transformação química.
III A molécula é a menor parte da substância que mantém os mesmos atributos desta, como o ponto de ebulição, o ponto de fusão e a densidade.
IV A substância cloreto de hidrogênio gasoso é classificada como ácida.
Estão certos apenas os itens
- A.
I e II.
- B.
I e III.
- C.
II e IV.
- D.
III e IV.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um experimento muito utilizado no ensino médio consiste na observação da reação de um comprimido efervescente com água em quatro diferentes situações, apresentadas a seguir.

O comprimido efervescente é composto de carbonato de sódio, bicarbonato de sódio, ácido cítrico e outras substâncias. Os resultados obtidos nesse experimento são os apresentados na tabela abaixo.

Considerando as informações acima, julgue os itens seguintes.
Na efervescência, é produzido o gás monóxido de carbono.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
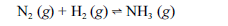
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Considerando que o NH3 tenha comportamento de gás ideal, em CNTP, o volume de gás amoníaco produzido anualmente é inferior a 200 mil m3.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

- A.
tubo 1: vermelho; tubo 2: amarelo
- B.
tubos 1 e 2: ambos amarelos
- C.
tubo 1: vermelho; tubo 2: azul
- D.
tubo 1: amarelo; tubo 2: azul
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um experimento muito utilizado no ensino médio consiste na observação da reação de um comprimido efervescente com água em quatro diferentes situações, apresentadas a seguir.

O comprimido efervescente é composto de carbonato de sódio, bicarbonato de sódio, ácido cítrico e outras substâncias. Os resultados obtidos nesse experimento são os apresentados na tabela abaixo.

Considerando as informações acima, julgue os itens seguintes.
A efervescência resulta da reação dos íons carbonato e bicarbonato com ácidos.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
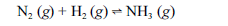
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Com base no princípio de Avogadro, a reação representada ocorre com contração de volume, visto que para cada 4V de volume dos gases que se combinam formam-se 2V de amônia.- C. Certo
- E. Errado


