Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considere-se que João tenha se deparado, no laboratório, com o desafio de tratar resíduos que contivessem íons cianeto e que, para proceder a esse tratamento, ele tenha feito uso de hipoclorito de sódio para oxidar o cianeto, dada a pequena quantidade desse resíduo. Considere-se, também, que tenha restado um excesso de hipoclorito na solução e que Ka (HlRO) = 3,2 × 10-8 . Nessa situação, é correto inferir que o pH da solução, após esse tratamento, é
- A.
ácido, devido à dissociação do ácido hipocloroso.
- B.
ácido, devido à dissociação do ácido perclórico.
- C.
básico, devido à hidrólise do hipoclorito.
- D.
neutro.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um prego de ferro enferruja espontaneamente quando é deixado em meio úmido e bastante arejado. Esse processo é explicado pelo conjunto de reações não-balanceadas apresentadas a seguir.
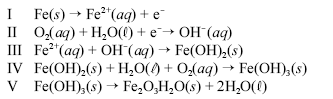
Considerando as informações acima, julgue os itens a seguir.
Sabendo que E0 oxidação do Fe é +0,44 volt e E0 oxidação do Zn é +0,763 volt, e que uma forma de proteger uma peça de ferro da corrosão é revestir o ferro com uma camada de zinco, então, se a superfície da peça for danificada, e o ferro ficar exposto, o zinco cederá elétrons e, em uma reação espontânea, o Fe ficará protegido.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considere-se, na situação hipotética descrita, que João tenha encontrado no laboratório 4 frascos que continham, no total, 3 L de uma solução neutra de sulfato cúprico e que ele tenha resolvido recuperar os íons Cu2+ eletrolisando a solução com eletrodos inertes, durante 193 min, com uma corrente média de 2,5 mA. Considere-se, ainda, que o processo reacional global seja representado pela equação química
2 Cu2+ (aq) + 2 H2O (l) → 2 Cu (s) + O2 (g) + 4 H+ (aq) e que o cobre metálico seja a única espécie a ser depositada no eletrodo e, ainda, que a constante de Faraday vale 96.500 C/mol. Nessa situação, é correto concluir que o pH da solução final é
- A.
inferior ou igual a 1.
- B.
superior a 1 e inferior ou igual a 4.
- C.
superior a 4 e inferior ou igual a 7.
- D.
superior a 7.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um prego de ferro enferruja espontaneamente quando é deixado em meio úmido e bastante arejado. Esse processo é explicado pelo conjunto de reações não-balanceadas apresentadas a seguir.
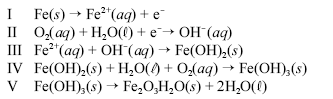
Considerando as informações acima, julgue os itens a seguir.
A equação III representa uma reação redox.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Deseja-se realizar um ensaio para determinação da potência nominal de um equipamento de combustão a gás. Para tal, determinou-se a vazão volumétrica do gás, medida a 15 ºC e 1 atm, como sendo 5m3.h-1. O gás utilizado como referência apresenta PCS, medido a 15 ºC e 1 atm, igual a 18 MJ.m-3. Determine a potência nominal do referido equipamento.
- A.
5 kW
- B.
10 kW
- C.
15 kW
- D.
20 kW
- E.
25 kW
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considerando que, na situação hipotética descrita, as soluções residuais encontradas no laboratório estavam perfeitamente identificadas e não continham outras substâncias, além das já identificadas, e, ainda, que
Eºred (Ag+ ) = 0,799 V; Eºred (Cu2+ ) = 0,337 V;
Kps [Cr(OH)3 ] = 3,0 × 10-29 ; Kps [PbS] = 3 × 10-28 , julgue os itens a seguir, no que se refere aos procedimentos adequados a essa situação.

- A.
1.
- B.
2.
- C.
3.
- D.
4.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um prego de ferro enferruja espontaneamente quando é deixado em meio úmido e bastante arejado. Esse processo é explicado pelo conjunto de reações não-balanceadas apresentadas a seguir.
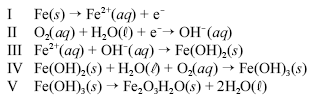
Considerando as informações acima, julgue os itens a seguir.
Quando corretamente balanceada, uma possível soma dos coeficientes da equação II é 11.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Um prego de ferro enferruja espontaneamente quando é deixado em meio úmido e bastante arejado. Esse processo é explicado pelo conjunto de reações não-balanceadas apresentadas a seguir.
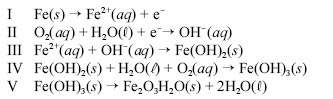
Considerando as informações acima, julgue os itens a seguir.
A reação II ocorre na região catódica do prego.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Em uma bomba calorimétrica de volume constante, que se encontra imersa em um banho de água a 25 ºC, queima-se propano gasoso com oxigênio puro. A energia transferida para ao líquido é de 4700 J.mol-1. Considere, ainda, que a variação de temperatura da água é pequena e que as propriedades físicoquímicas das substâncias permanecem inalteradas. Determine a entalpia de combustão do propano gasoso nas condições descritas. (Dados: R = 8,314 J.mol-1K-1 )
- A.
-7,17 kJ.mol-1
- B.
-2,22 kJ.mol-1
- C.
2,22 kJ.mol-1
- D.
4,70 kJ.mol-1
- E.
4,70 kJ.mol-1
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
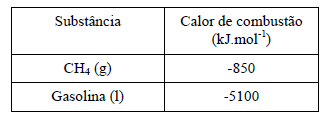
Considerando os dados da tabela abaixo, calcule o volume, nas CNTP, de gás natural cuja combustão libera a mesma quantidade de calor que um mol de gasolina. (Dado: R= 0,082 atm.L.mol- 1.K-1)
- A.
0,134 m3
- B.
0,156 m3
- C.
13,4 m3
- D.
15,6 m3
- E.
134 m3


