Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP)
Lista completa de Questões de Química da Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Qual a concentração das espécies H+ e OH, bem como os valores de pH e pOH de uma solução 0,01 mol/L de HCl?
- A.
[H+] = 1 x 10 2 mol/L; [OH] = 1 x 10 12 mol/L; pH = 2,0; pOH = 12,0.
- B.
[H+] = 2 x 10 1 mol/L; [OH] = 2 x 10 12 mol/L; pH = 3,0; pOH = 11,0.
- C.
[H+] = 0,05 mol/L; [OH] = 0,05 mol/L; pH = 5,0; pOH = 9,0.
- D.
[H+] = 1 x 10 2 mol/L; [OH] = 1 x 10 12 mol/L; pH = 1,0; pOH = 14,0.
- E.
[H+] = 0,05 mol/L; [OH] = 0,05 mol/L; pH = 7,0; pOH = 7,0.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Qual o volume necessário da solução contendo 500 mg/L de boro (solução estoque) para preparar 100 mL de solução contendo 10 mg/L de B?
- A.
É necessário transferir 20 mL da solução estoque de boro para balão volumétrico de 100 mL e completar o volume com água deionizada.
- B.
É necessário transferir 2 mL da solução estoque de boro para balão volumétrico de 100 mL e adicionar mais 100 mL de água deionizada.
- C.
É necessário transferir 1 mL da solução estoque de boro para balão volumétrico de 100 mL e completar o volume com água deionizada.
- D.
É necessário transferir 2 mL da solução estoque de boro para balão volumétrico de 100 mL e completar o volume com água deionizada.
- E.
É necessário transferir 5 mL da solução estoque de boro para balão volumétrico de 100 mL e completar o volume com água deionizada.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Calcule o volume ocupado, a 20 °C, por 500 g de uma solução de ácido sulfúrico de densidade 1,84 g/cm3.
- A.
920 mL.
- B.
920 L.
- C.
271,7 mL.
- D.
271,7 L.
- E.
500 mL.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
50 mol/kg.
- B.
26,25 mmol/kg.
- C.
26,25 mol/kg.
- D.
14,7 mol/ kg.
- E.
50 mmol/kg.

- A.
-176 kJ/mol.
- B.
176 kJ/mol.
- C.
-452 kJ/mol.
- D.
452 kJ/mol.
- E.
360 kJ/mol.

- A.
891 kJ/mol reação exotérmica.
- B.
755 kJ/mol reação endotérmica.
- C.
-891 kJ/mol reação endotérmica.
- D.
605 kJ/mol reação endotérmica.
- E.
-891 kJ/mol reação exotérmica.
Química - Química Orgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Que espécies são as precursoras da fuligem em uma chama?
- A.
Parafinas.
- B.
Olefinas.
- C.
Halogênios.
- D.
Olefinas.
- E.
Hidrocarbonetos policíclicos aromáticos.
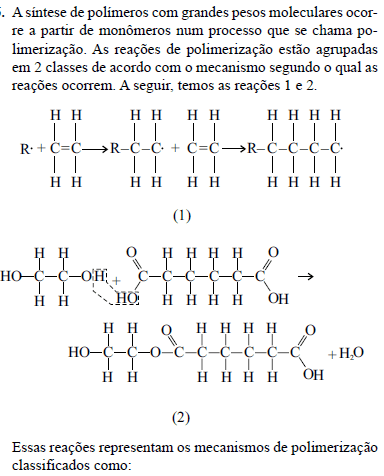
- A.
(1) reação de radicais livres; (2) polimerização por adição.
- B.
(1) reação de esterificação; (2) polimerização por adição.
- C.
(1) polimerização por condensação; (2) reação de dissociação.
- D.
(1) polimerização por condensação; (2) polimerização por adição.
- E.
(1) polimerização por adição; (2) polimerização por condensação.
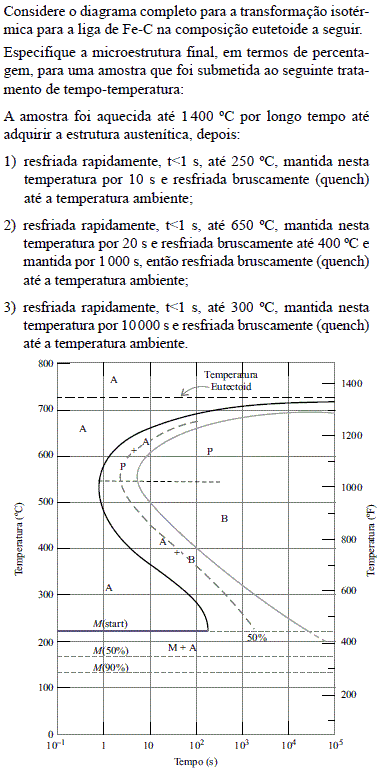
- A.
1) 100% Bainita, 2) 50% Perlita e 50% Bainita, e 3) 100% Martensita.
- B.
1) 100% Bainita, 2) 50% Austenita e 50% Bainita, e 3) 100% Martensita.
- C.
1) 100% Austenita, 2) 50% Perlita e 50% Austenita, e 3) 100% Martensita.
- D.
1) 100% Martensita, 2) 50% Austenita e 50% Perlita, e 3) 100% Bainita.
- E.
1) 100% Martensita, 2) 50% Perlita e 50% Bainita, e 3) 100% Bainita.
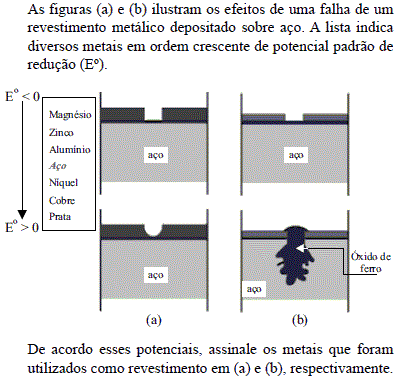
- A.
Prata e cobre.
- B.
Magnésio e zinco.
- C.
Zinco e alumínio.
- D.
Zinco e prata.
- E.
Cobre e zinco.


